شیمی دبیرستان را فراموش کنید: ساخت ترکیب پایداری از هلیوم
اگر شیمی دبیرستان را به یاد داشته باشید، میدانید که هلیوم گازی نجیب است، کمترین میزان واکنشپذیری را در جدول تناوبی دارد و چون بیرونیترین لایهی الکترونی آن پر است، با دیگر عنصرها واکنش نمیدهد تا ترکیبهای پایدار ایجاد کند.
دیگر گازهای نجیب تحت فشار زیاد ترکیباتی را ایجاد کردهاند؛ اما تاکنون هلیوم ترکیب پایداری ایجاد نکرده بود. دانشمندان گزارش دادهاند که ترکیبی ساختهاند که به نظر میرسد ترکیب پایداری از هلیوم و سدیم باشد. ساخت این ترکیب بسیاری از فرضیات اساسی شیمی مدرن را زیر سوال میبرد.
آدام پاپاو از دانشگاه یوتا و از اعضای تیم میگوید:
وقتی فشارهای بالا را اعمال میکنید، شیمی تغییر میکند. این فشارهای بالا در داخل زمین و در سیارههای متفاوتی مانند زحل قابل دستیابی است. اما این پژوهش بسیاری از معادلات را به هم میزند.
هلیوم دومین عنصر فراوان در جهان است و در بالای گروه شش عضوی گازهای نجیب قرار گرفته است. آخرین لایهی الکترونی این عنصرها که عامل واکنشپذیری آنها هم است، پر است؛ بنابراین این گازها با دیگر عنصرها واکنش نمیدهند و ترکیبی ایجاد نمیکنند.
این گازها از این جهت نجیب نامیده میشوند که با عنصرهای دیگر واکنش نمیدهند. البته در شرایط ویژه میتوانید نشانههایی از واکنشپذیری آنها را مشاهده کنید. گازهای نجیب به دو دسته تقسیم میشوند: گروه اول شامل کریپتون، زنون و رادون تا حدودی واکنشپذیر شناخته میشوند؛ گروه دیگر شامل آرگون، نئون و هلیوم کاملا واکنشناپذیر محسوب میشوند.
پژوهشگران راههایی برای اتصال هلیوم به دیگر عنصرها یافته بودند؛ اما تاکنون نتایج ناپایدار بودند. از برهمکنشهای هلیوم با دیگر عنصرها میتوان به پیوند واندروالس اشاره کرد. نیروی واندروالس، جزو نیروهای جاذبه یا دافعه است که بدون نیاز به پیوند کووالانسی یا یونی شکل میگیرد. در واقع پیوند کووالانسی یا یونی، با اشتراکگذاری الکترونها بین اتمها شکل میگیرد تا یک مولکول ایجاد شود. اما پیوند واندروالسی، نیروی ضعیفتری است که بین مولکولها یا اتمهای منفرد شکل میگیرد، بی آنکه مولکولی ایجاد کند.
پیوند واندروالس بین هلیوم و دیگر اتمها وجود دارد. در دماهای بسیار پایین، هلیوم میتواند "مولکولهای واندروالسی" ایجاد کند. مولکولهای واندروالسی خوشههایی از اتمها یا مولکولها هستند که نیروی اتصال دهندهی آنها بسیار ضعیف بوده و ناپایدار نیز هستند.
هلیوم واکنش پذیر نیست؛ زیرا آرایش الکترونی لایهی بیرونی آن کامل است. در واقع آرایش الکترونی لایهی آخر آن جایی برای به اشتراکگذاری الکترون با دیگر اتمها ندارد تا پیوند ایجاد شود. اما این شرایط روی سطح زمین برقرار هستند.
هلیوم یکی از فراوانترین عنصرهای هستی است و در شکلگیری ستارهها و سیارههای غولپیکر نقش دارد. هلیوم در فضا و در هستهی زمین، بسیار متفاوت عمل میکند. اکنون پژوهشگران موفق شدهاند تا نخستین شواهد از این رفتار عجیب را بیابند.
آلکس بولدروف، یکی از اعضای تیم از ایالت یوتا میگوید:
فشارهای خیلی بالا، مثل فشار مرکز کرهی زمین یا فشار سیارههای گازی همسایه کاملا شیمی هلیوم را تغییر میدهد.
پژوهشگران از یک مدل کامپیوتری پیشبینیکنندهی ساختار کریستال استفاده کردند تا پیشبینی کنند که آیا در فشارهای خیلی بالا، ترکیب پایدار هلیوم-سدیم میتواند شکل بگیرد یا خیر. آنها سپس این ترکیب، یعنی Na2He را در یک سندان الماس ساختند. این سندان الماس امکان دستیابی به فشار ۱.۱ میلیون برابر فشار اتمسفری زمین را ممکن میسازد. بولدروف میگوید که این نتایج غیر قابل انتظار بودند و آنها بیش از دو سال تلاش کردند تا بازخوانها و سردبیران ساینس را متقاعد کنند که نتایج آنها را چاپ کنند. تیم با توجه به این نتایج پیشبینی میکند که تحت شرایط فشار ۱۰ میلیون برابر فشاری که آنها به آن دست یافته اند، سدیم به راحتی با گاز هلیوم ترکیب میشود و ترکیب Na2He را ایجاد میکند. عجیب است که این ترکیب بدون هیچ پیوند شیمیایی که آنها را در کنار هم نگاه دارد، ایجاد میشود.
ژائو دانگ از دانشگاه نانکای در چین در بیانیهای گفته است:
ترکیبی که یافتهایم، بسیار ویژه است: اتمهای هلیوم پیوند شیمیایی تشکیل ندادهاند؛ اما حضور آنها برهمکنشهای شیمایی بین اتمهای سدیم را تغییر داده و الکترونها را داخل حفرههای ساختار مکعبی مستقر کرده است.
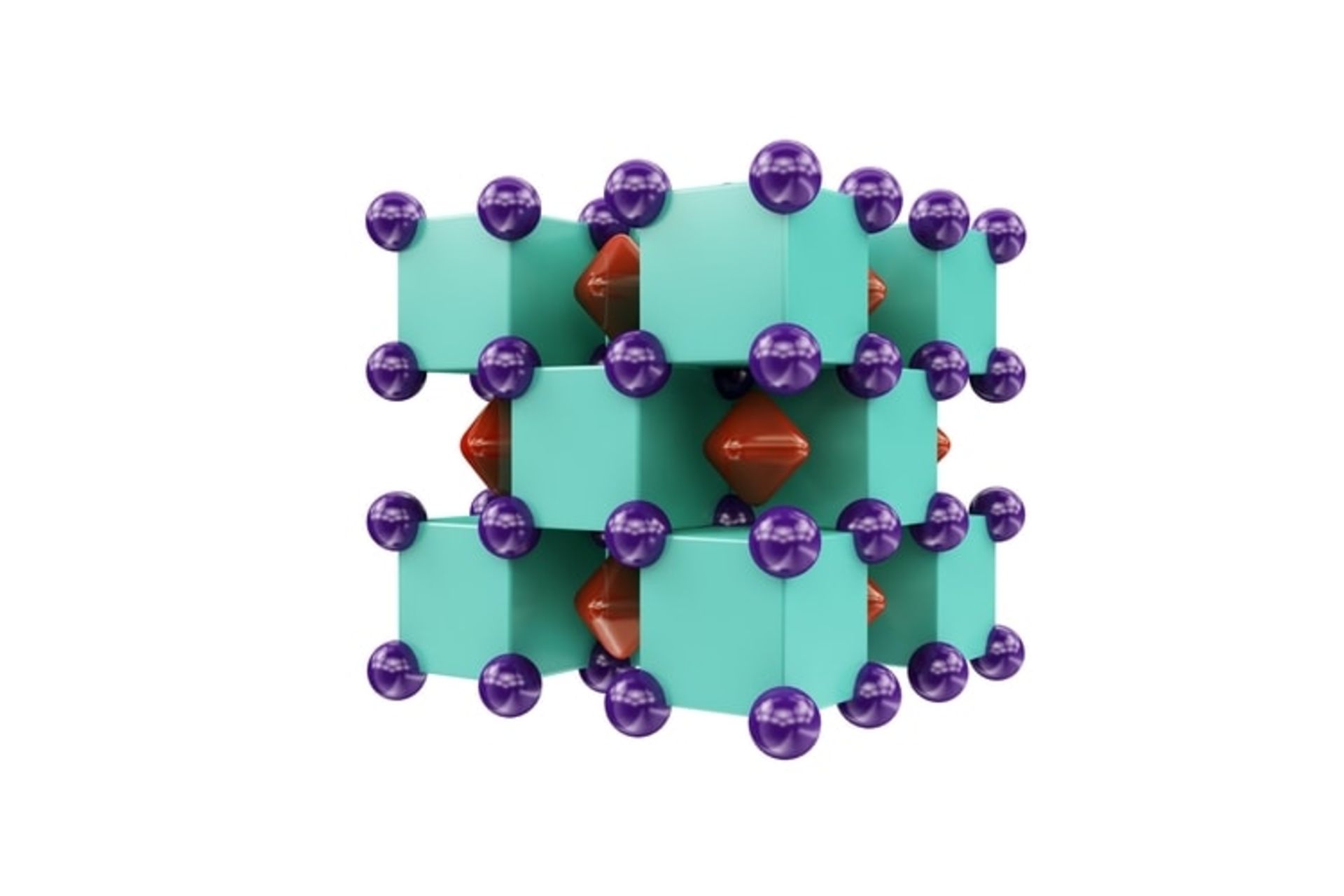
در تصویر زیر، ساختار کریستالی Na2He را میبینید. اتمهای سدیم به رنگ بنفش و اتمهای هلیوم سبز هستند. الکترونها فضاهای قرمز بین آنها هستند.

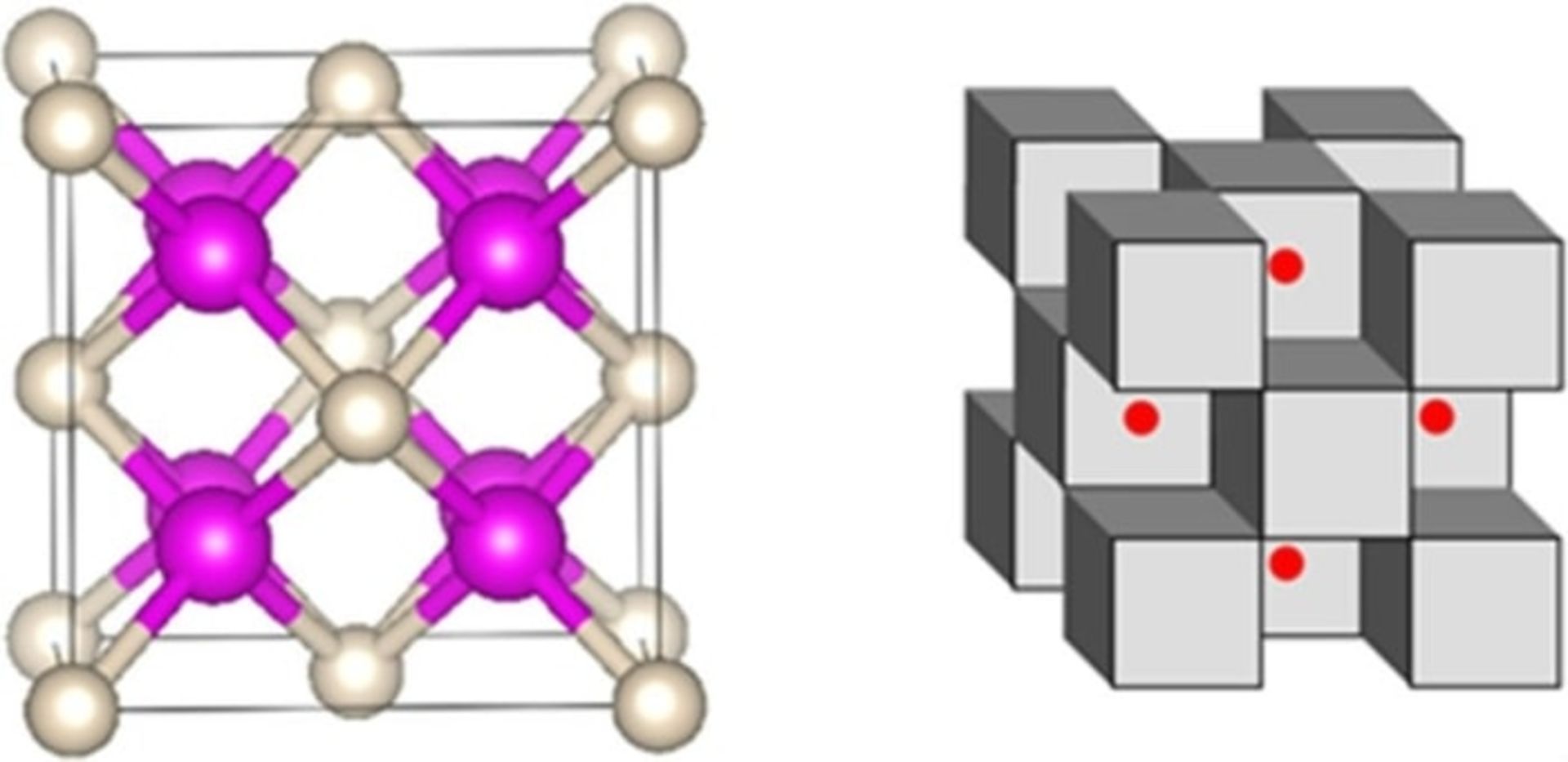
پاپوف میگوید که پیوند تشکیل شده، پیوندی واقعی مانند پیوندهای یونی یا کووالانسی نیست؛ اما این هلیوم است که ساختار را پایدار کرده است. اگر اتمهای هلیوم را حذف کنید، این ساختار پایدار نخواهد بود. در اینجا چند بازنمود دیگر از این ترکیب را میبینید. در تصویر سمت چپ، سدیم صورتی و هلیوم سفید است. در تصویر سمت راست، مکعبهای سدیم و هلیوم خاکستری و الکترونها قرمز هستند:
اخیرا شیمی دانها اکتشافات خارج از قاعدهی زیادی انجام دادهاند. تیمهای جداگانهای نخستین نمونه از هیدروژن فلزی و مولکول کربنی با ۶ پیوند (و نه چهارپیوند) را ساختهاند؛ اما چون این نتایج با عقل سلیم مطابقت ندارند، با شک بسیاری با آنها برخورد میشود و معمولا کسی به سراغ تکرار آزمایش نمیرود. نتایج این مطالعه به نظر معتبر میرسند؛ بنابراین منتظر نتایج جالب آزمایشهای بعدی خواهیم ماند.
هنری رپا، از کالج امپریال لندن، در این مطالعه شرکت نداشته است. او با مقایسهی کشف هیدروژن فلزی و پیوندهای هلیوم میگوید:
این پژوهش علمیتر است. ترکیب هلیوم میتواند پیشرفتی بزرگ در علم باشد.
باید آزمایشهای بیشتری انجام شوند تا اطلاعات بیشتری به دست بیاوریم. تا به اینجا به نظر میرسد که سال ۲۰۱۷ سالی است که بسیاری از باورهای شیمی قدیمی ما را به چالش کشیده است و نمیتوان منتظر بود و دید که دیگر چه اکتشافاتی صورت خواهد پذیرفت.
نتایج این پژوهش در Nature Chemistry چاپ شده است.
نظرات