چرا ۹۰ درصد از داروها در کارآزماییهای بالینی شکست میخورند؟

ده تا پانزده سال طول میکشد و به حدود یک میلیارد دلار نیاز است تا داروی موفقی ساخته شود. با وجود این سرمایهگذاریهای قابلتوجه در زمان و پول، ۹۰ درصد از گزینههای دارویی در کارآزماییهای بالینی شکست میخورند. بسیاری از گزینههای دارویی به دلیل اینکه وضعیتی را که قرار است مورد هدف قرار دهند، بهخوبی درمان نمیکنند یا عوارض جانبی شدیدی دارند؛ هرگز به مرحله تأیید نمیرسند.
داکسین سان، استاد علوم داروسازی دانشگاه میشیگان میگوید: «بهعنوان دانشمند متخصص داروسازی که در زمینهی تولید دارو کار میکنم، از این نرخ بالای شکست ناامید شدهام. در طول ۲۰ سال گذشته، آزمایشگاه من (آزمایشگاه سان در دانشگاه میشیگان) درحال بررسی روشهایی برای بهبود این فرایند بوده است. ما بر این باوریم که تغییر نحوه انتخاب گزینههای دارویی بالقوه میتواند موجب نرخ موفقیت بالاتر و در نهایت داروهای بهتر شود.»
روند ساخت داروها چگونه است؟
در طول چند دهه گذشته، توسعه دارو از فرایندی کلاسیک پیروی کرده است. پژوهشگران کار خود را با پیدا کردن هدف مولکولی که موجب بیماری میشود، آغاز میکنند. برای مثال، هدف مولکولی میتواند پروتئینی باشد که بیشازحد تولید میشود و در صورتی که مهار شود، میتواند به توقف رشد سلولهای سرطان کمک کند. آنها سپس آرشیوی از ترکیبات شیمیایی را مورد جستوجو قرار میدهند تا گزینههای دارویی بالقوهای را که روی آن هدف عمل میکنند، پیدا کنند. وقتی ترکیب امیدوارکنندهای پیدا شد، پژوهشگران آن را در آزمایشگاه بهینهسازی میکنند.
بهینهسازی دارو عمدتاً بر دو جنبه از دارو تمرکز دارد. اول اینکه، داروی بالقوه باید بتواند با قدرت مولکول هدف خود را بدون تاثیرگذاشتن بر اهداف نامربوط مهار کند. بهمنظور بهینهسازی «قدرت» و «ویژگی»، پژوهشگران روی رابطه ساختار-فعالیت ترکیب یا اینکه ساختار شیمیایی ترکیب مذکور چگونه فعالیت آن را در بدن تعیین میکند، تمرکز میکنند. دوم این که ترکیب باید دارومانند باشد، یعنی بتواند از راه خون جذب و منتقل شود تا روی هدف موردنظر خود در اعضای درگیر بیماری اثر بگذارد.
هنگامی که گزینه دارویی بالقوهای با معیارهای بهینهسازی پژوهشگران مطابقت داشته باشد، وارد آزمایشهای کارایی و ایمنی، ابتدا در حیوانات و سپس در کارآزماییهای بالینی انسانی میشود.
چرا ۹۰ درصد از موارد توسعه داروهای بالینی شکست میخورند؟
از هر ده کاندیدای دارویی فقط یک مورد با موفقیت آزمایش بالینی را پشت سر میگذارد و تأیید میشود. تجزیهوتحلیلی از سال ۲۰۱۶، چهار دلیل احتمالی را برای این نرخ موفقیت پایین شناسایی کرد.
بین ۴۰ تا ۵۰ درصد از شکستها ناشیاز عدم کارایی بالینی بود، یعنی دارو نمیتوانست اثر موردنظر را در افراد ایجاد کند. حدود ۳۰ درصد از موارد به دلیل سمیت یا اثرات جانبی غیرقابلکنترل بود و ۱۰ تا ۱۵ درصد ناشیاز ویژگیهای فارماکوکینتیک ضعیف داروها بود (میزان جذب و دفع دارو توسط بدن). در نهایت، ۱۰ درصد از شکستها به عدم علاقه تجاری و سرمایهگذاری روی آن و برنامهریزی استراتژیک ضعیف نسبت داده شد.
نرخ بالای شکست داروهای بالقوه، این سؤال را به وجود میآورد که آیا جنبههای دیگری از توسعه دارو وجود دارد که نادیده گرفته شده باشد. از یک طرف، تأیید این مسئله چالشبرانگیز است که هدف مولکولی انتخابشده واقعاً بهترین نشانگر برای غربالگری داروها برحسب آن است. از سوی دیگر، این امکان وجود دارد که فرایند کنونی بهینهسازی دارو به انتخاب بهترین گزینهها برای آزمایش بیشتر منجر نشود.
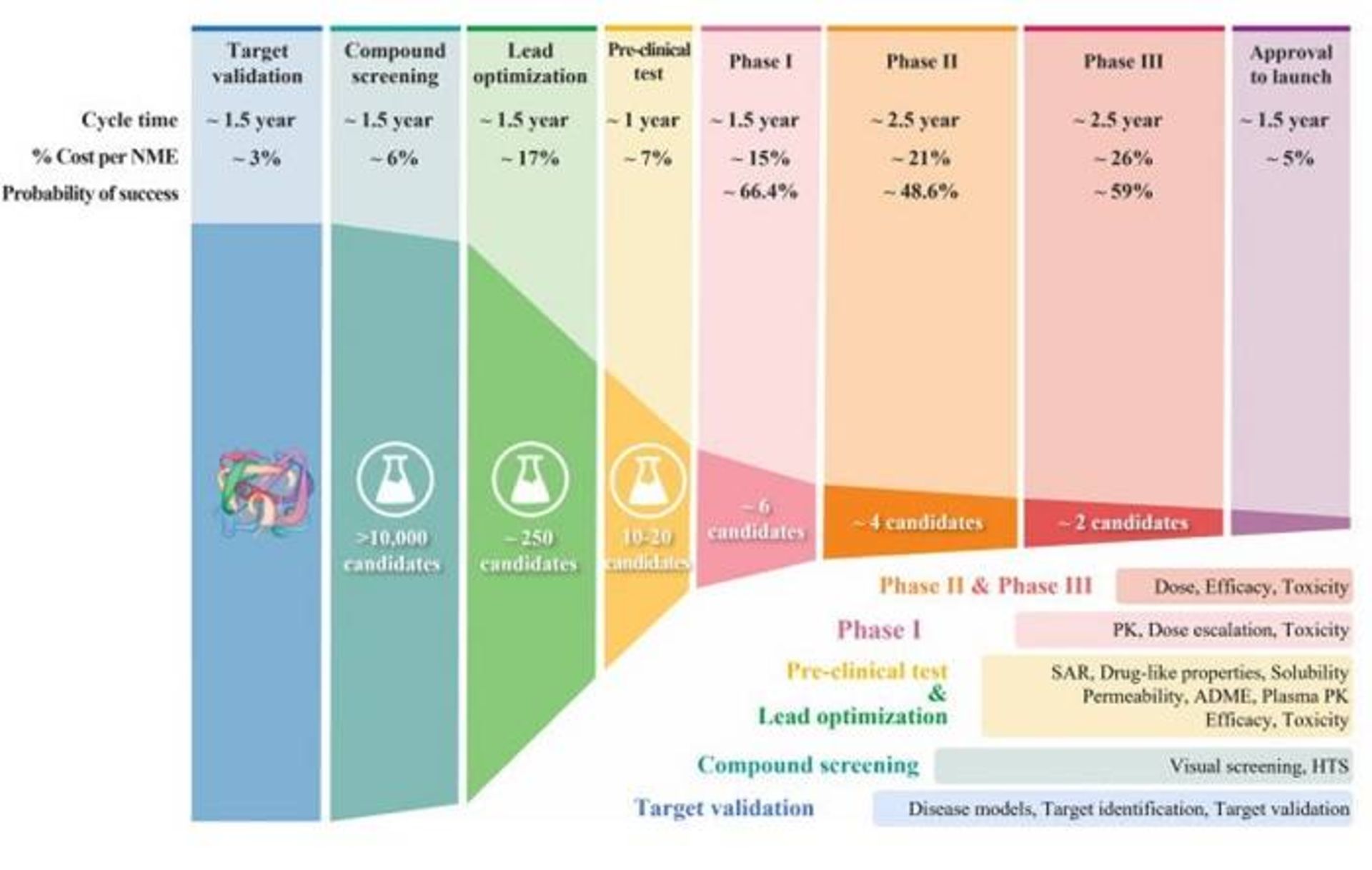
با هر مرحله متوالی از فرایند ساخت دارو، احتمال موفقیت بهطور فزایندهای کمتر میشود.
کاندیداهای دارویی که به کارآزماییهای بالینی میرسند، باید به این توازن ظریف برسند که مقدار کافی از دارو را به بدن تحویل دهند که بدون ایجاد آسیب، تأثیر موردنظر را داشته باشد. بهینهسازی تونایی دارو برای هدفگیری دقیق و عمل قوی روی هدف به وضوح در توانایی آن برای ایجاد آن توازن مهم است.
اما برخی پژوهشگران معتقدند که بر این جنبه از عملکرد دارو بیشازحد تأکید شده است. آنها میگویند بهینهسازی توانایی دارو برای رسیدن به قسمتهای بیمار بدن در سطح کافی و درعینحال پرهیز از قسمتهای سالم بدن به همان اندازه مهم است.
برای مثال، دانشمندان ممکن است سالهای زیادی را صرف بهینهسازی قدرت (potency) و ویژگی (specificity) کاندیداهای دارویی کنند تا در غلظتهای بسیار پایین بر اهداف خود تأثیر بگذارند؛ اما این تمرکز ممکن است به قیمت اطمینان از رسیدن مقدار کافی از دارو به بخشهای موردنظر بدن و عدم آسیب زدن به بافتهای سالم تمام شود. پژوهشگرانی که استراتژی جدید را پیشنهاد میکنند، بر این باورند که این روند نامتعادل بهینهسازی دارو ممکن است انتخاب کاندیدای دارویی را منحرف کند و بر عملکرد نهایی آن در کارآزماییهای بالینی اثر بگذارد.
بهبود فرایند توسعه دارو
در طول چند دهه گذشته، دانشمندان ابزارها و استراتژیهای بهبود موفقیتآمیزی را برای هر مرحله از فرایند ساخت دارو ایجاد کردهاند و به کار بردهاند. این موارد شامل غربالگری با کارایی بالا است که از رباتها برای اتوماتیک کردن میلیونها آزمایش در آزمایشگاه استفاده میکند و روند شناسایی کاندیداهای بالقوه را سرعت میبخشد؛ طراحی دارو به کمک هوش مصنوعی؛ روشهای جدید پیشبینی و آزمایش سمیت و انتخاب دقیقتر بیمار در کارآزماییهای بالینی است. اگرچه با وجود این استراتژیها، نرخ موفقیت هنوز تغییر زیادی نکرده است.
پژوهشگران مطالعه جدید معتقدند که به کمک استراتژیهای جدید و تمرکز روی اولین مراحل توسعه دارو، زمانی که پژوهشگران درحال انتخاب ترکیبات بالقوه هستند، ممکن است به افزایش موفقیت کمک کند. این کار را میتوان به کمک فناوریهای جدیدی مانند ابزار ویرایش ژن کریسپر انجام داد که میتواند با دقت بیشتری هدف مولکولی را که موجب بیماری میشود، تأیید کند و نیز نشان میدهد که آیا دارویی واقعا آن را مورد هدف قرار میدهد.
همچنین این کار را میتوان ازطریق سیستم STAR جدیدی انجام داد که پژوهشگران برای کمک به انتخاب استراتژیهای بهتر برای ایجاد تعادل میان چند عامل برای ساخت داروی بهینه طراحی کردهاند.
سیستم استار به جنبه انتخابپذیری (selectivity) و مواجهه با بافت (tissue exposure) دارو که در گذشته زیاد موردتوجه قرار نگرفته است، اهمیتی به اندازه قدرت و ویژگی دارو میدهد. این بدان معنا است که توانایی دارو برای رسیدن به قسمتهای بیمار در سطوح کافی به اندازه دقتی که میتواند با آن بر هدف خود تأثیر بگذارد، بهینه میشود. برای انجام این کار، سیستم مذکور داروها را براساس این دو جنبه به همراه دوز توصیهشده به چهار دسته طبقهبندی میکند. کلاسهای مختلف به استراتژیهای بهینهسازی متفاوتی پیش از ورود به آزمایشهای بیشتر نیاز دارند.
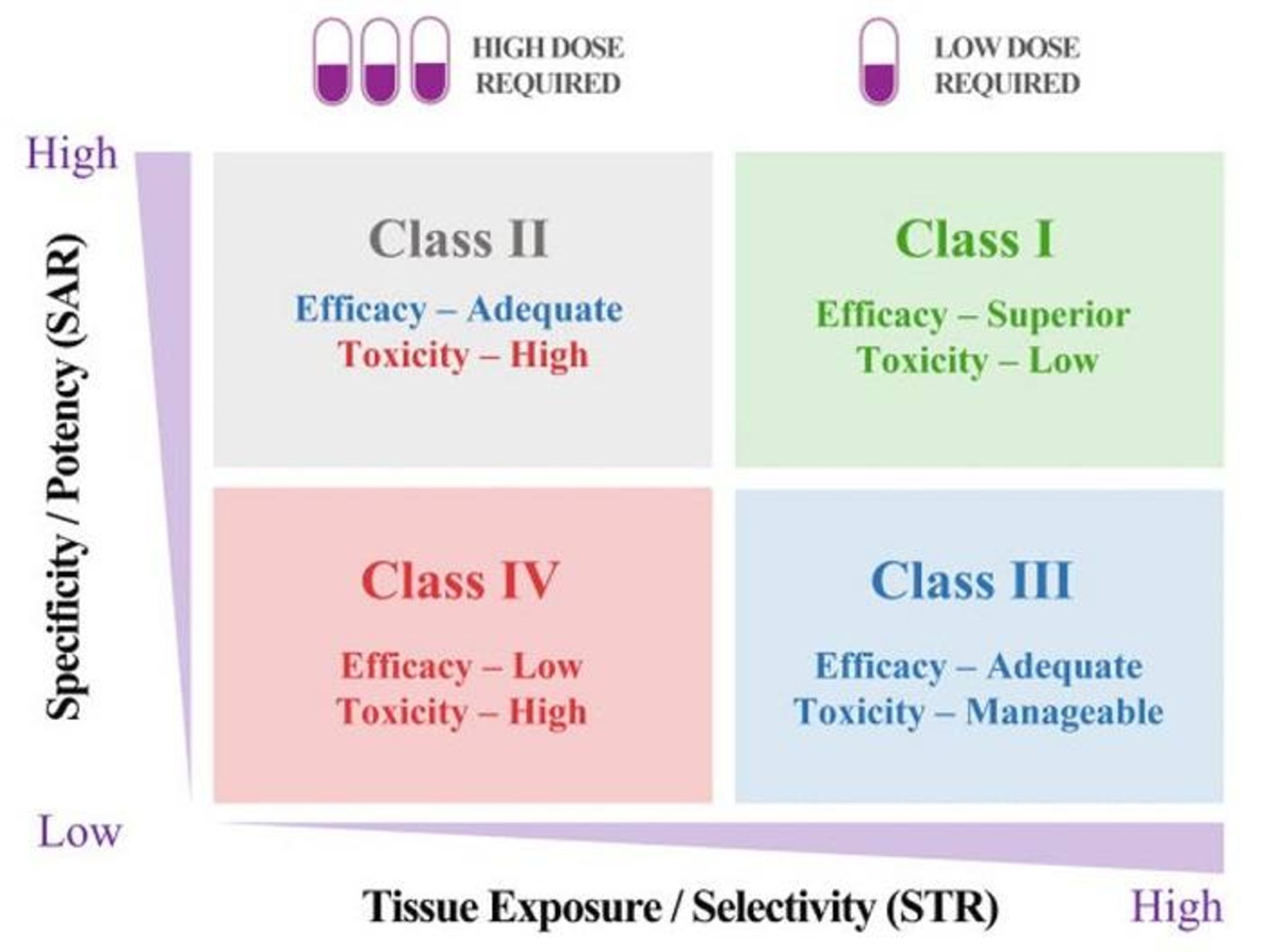
سیستم استار با در نظر گرفتن عوامل مختلفی که در موفقیت بالینی دارو نقش دارند، روش سیستماتیکی برای رسیدن به انتخاب کاندیدای دارویی ارائه میدهد.
بهعنوان مثال، کاندیدای دارویی کلاس I، دارای قدرت/ویژگی بالا و نیز مواجههبا بافت/انتخابپذیری بالا است. برایناساس، این گزینه برای به حداکثر رساندن کارایی و ایمنی به دوز پایینی نیاز دارد و مطلوبترین مورد برای بررسی بیشتر است.
از سوی دیگر، کاندیدای داروی کلاس چهار (IV) دارای قدرت/ویژگی پایین و نیز مواجهه با بافت/انتخابپذیری پایین خواهد بود. بنابراین، این گزینه احتمالاً کارایی ناکافی و سمیت بالا دارد و نباید در آزمایشهای بیشتر بررسی شود.
کاندیداهای دارویی کلاس II دارای ویژگی/قدرت بالا هستند ولی مواجهه با بافت/انتخابپذیری پایینی دارند. بنابراین، برای دستیابی به کارایی کافی به دوز بالایی نیاز خواهند داشت، اما ممکن است سمیت غیرقابل کنترلی داشته باشند. این کاندیداها به ارزیابی محتاطانهتری نیاز دارند.
در نهایت، کاندیداها دارویی کلاس III، دارای ویژگی/قدرت نسبتاً پایین اما مواجهه با بافت/انتخابپذیری بالا خواهند بود، بنابراین، ممکن است برای دستیابی به کارایی کافی با سمیت قابلکنترل به دوز پایین تا متوسط نیاز داشته باشند. این کاندیداها ممکن است نرخ موفقیت بالینی بالایی داشته باشند، اما غالباً نادیده گرفته میشوند.
انتظارات واقعبینانه برای توسعه دارو
رساندن یک کاندیدای دارویی به مرحلهی کارآزمایی بالینی برای هر شرکت داروسازی یا نهاد دانشگاهی که مشغول ساخت داروهای جدید است، کار بزرگی است. این مسئله ناامیدکننده است که سالها تلاش و منابعی که صرف رساندن یک کاندیدای دارو به بیماران میشود، اغلب به شکست منجر میشود. بهبود فرایند انتخاب دارو و بهینهسازی ممکن است بهطور قابلتوجهی نرخ موفقیت کاندیدای خاص را افزایش دهد.
اگرچه به علت ماهیت توسعه دارو، ممکن است رسیدن به نرخ موفقیت ۹۰ درصد آسان نباشد، پژوهشگران بر این باورند که حتی پیشرفتهای متوسط میتواند بهطور قابلتوجهی هزینه و زمانی را که صرف پیدا کردن درمانی برای بسیاری از بیماریهای انسانی میشود، کاهش دهد.
نظرات