
هفت فناوری تحولآفرین در سال ۲۰۲۳
جمعه ۷ بهمن ۱۴۰۱ - ۲۲:۳۰مطالعه 13 دقیقهاز توالییابی پروتئین گرفته تا تصویربرداری به کمک میکروسکوپ الکترونی و از باستانشناسی تا نجوم، در ادامه به انتخاب نشریه نیچر به هفت فناوری اشاره میشود که احتمالاً در سال پیش رو علم را دگرگون خواهند کرد.
توالییابی پروتئین تکمولکول
پروتئوم مجموعه کامل پروتئینهایی است که توسط سلول یا ارگانیسم ساخته میشود و میتواند دارای اطلاعات فراوانی درمورد سلامتی و بیماری باشد. اگرچه، تعیین اجزای پروتئوم همچنان چالشبرانگیز است.
پروتئینها نسبتبه اسیدهای نوکلئیک از الفبای بزرگتری از واحدهای ساختمانی ساخته میشوند. پروتئینها به کمک تقریبا ۲۰ اسید آمینه طبیعی ساخته میشوند (درمقابل، چهار نوکلئوتید که مولکولهایی مانند دیانای یا آرانای پیامرسان را تشکیل میدهند) و این امر منجر به تنوع شیمیایی بسیار بیشتری میشود.
فراوانی برخی از پروتئینها در سلول بسیار کم است و برخلاف اسیدهای نوکلئیک، پروتئینها را نمیتوان تکثیر کرد، یعنی روشهای تجزیهوتحلیل پروتئین باید بتواند با همان مقدار مادهای که در دسترس است، کار کند.
در بیشتر تجزیهوتحلیلهای پروتئومی از طیفسنجی جرمی استفاده میشود. طیفسنجی جرمی تکنیکی است که مخلوطی از پروتئینها را براساس جرم و بار آنها شناسایی میکند. این پروفایلها میتوانند بهطور همزمان هزاران پروتئین را به صورت کمی نشان دهند، اما مولکولهای تشخیص دادهشده همیشه به طور واضح شناسایی نمیشوند و پروتئینهایی که فراوانی آنها در مخلوط کم باشد، اغلب نادیده گرفته میشوند.
اکنون فناوریهای تک مولکولی در راه هستند که میتوانند بسیاری از پروتئینهای درون یک نمونه را توالییابی کنند. بسیاری از این فناوریها مشابه تکنیکهای مورد استفاده برای توالییابی دیانای هستند.
ادوارد مارکوت، بیوشیمیدان دانشگاه تگزاس در آستین، یکی از این رویکردها را دنبال میکند که فلوروسکوئنسینگ (fluorosequencing) نامیده میشود.
تکنیک مارکوت که سال ۲۰۱۸ گزارش شد، مبتنیبر فرایند شیمیایی مرحلهداری است که در آن اسیدهای آمینه جداگانه با استفاده از نشانگرهای فلورسنت نشانهگذاری میشوند و سپس یکی یکی از انتهای پروتئینی که روی سطح شیشهای ساکن است، جدا میشوند و در همان زمان دوربین سیگنال فلورسنت حاصل را ثبت میکند. مارکوت توضیح میدهد: «میتوانیم پروتئینها را با رنگهای فلورسنت مختلف برچسبگذاری کنیم و سپس وقتی مولکولها دانه دانه جدا میشوند، آنها را تحتنظر داشته باشیم.»
سال گذشته پژوهشگران شرکت بیوتکنولوژی Quantum-Si در گیلفورد ایالت کنتیکت جایگزینی را برای فلوروسکوئنسینگ توصیف کردند که از پروتئینهای اتصالدهنده نشانهگذاریشده با فلورسنت استفاده میکند تا توالیهای خاصی از اسیدهای آمینه (یا پلیپپتیدها) را در انتهای پروتئینها شناسایی کند.
پژوهشگران دیگر درحال توسعه تکنیکهایی هستند که از توالییابی دیانای مبتنیبر نانوحفره تقلید میکنند و پلیپپتدها را براساس تغییراتی که حین عبور از کانالهای ریز در جریان الکتریکی ایجاد میکنند، شناسایی میکنند. سیس دکر، بیوفیزیکدان دانشگاه فناوری دِلفت هلند و همکارانش یکی از این رویکردها را در سال ۲۰۲۱ با استفاده از نانوحفرههای ساختهشده از پروتئین نشان دادند و توانستند در پلیپپتیدی که از منافذ عبور میکرد، بین اسیدهای آمینه انفرادی تمایز قائل شوند.
در مؤسسه تخنیون، تیم آمیت ملر درحال کار روی دستگاههای نانوحفره حالت جامد است. این نانوحفرهها از مواد مبتنیبر سیلیکون ساخته شدهاند که میتواند تجزیهوتحلیل همزمان تعداد زیادی پروتئین را امکانپذیر کند. او میگوید: «ممکن است بتوانید بهطور همزمان دهها هزار یا حتی میلیونها نانوحفره را بررسی کنید.»
اگرچه توالییابی پروتئین تک مولکولی درحالحاضر فقط یک اثبات مفهوم است، تجاریسازی آن به سرعت درحال انجام است. برای مثال، شرکت Quantum-Si برنامههایی برای عرضهی ابزارهای نسل اول خود در سال جاری دارد و ملر خاطرنشان میکند که در کنفرانس توالییابی پروتئین که نوامبر ۲۰۲۲ در دانشگاه دلفت برگذار شد، درمورد فعالیت استارتاپها در این حوزه بحث شد. او میگوید: «این روزها مرا به یاد روزهای اولیه قبل از رسیدن فناوریهای نسل جدید توالییابی دیانای میاندازد.»
مارکوت همبنیانگذار شرکت توالییابی پروتئین Erisyon در آستین تگزاس، خوشبین است. او میگوید: «مسئله این نیست که آیا این روش کارآمد است، بلکه این است که چه زمانی به دست مردم خواهد رسید.»
تلسکوپ فضایی جیمز وب
اخترشناسان سال گذشته هیجان زیادی را تجربه کردند. پس از فرایند طراحی و ساخت تلسکوپ فضایی جیمز وب (JWST) که بیش از دو دهه طول کشید، ناسا با همکاری آژانسهای فضایی اروپا و کانادا این تلسکوپ فضایی را با موفقیت در تاریخ ۲۵ دسامبر ۲۰۲۱ پرتاب کرد.
جهان حدود هفت ماه منتظر ماند تا اینکه تلسکوپ به طور کامل باز شد و برای اولین دور از مشاهدات خود جهتگیری کرد. این انتظار ارزشش را داشت. مت مانتین، ستارهشناس موسسه علوم تلسکوپ فضایی در بالتیمور که یکی از دانشمندان تلسکوپ JWST است، میگوید تصاویر اولیه فراتر از انتظارات او بوده است. او میگوید: «درحقیقت آسمانِ خالی وجود ندارد. کهکشانها همه جای آسمان هستند. ما ازنظر تئوری این موضوع را میدانستیم، اما تأثیر عاطفی ناشی از مشاهده آن بسیار متفاوت است.»

تلسکوپ فضایی جیمز وب به گونهای طراحی شده است که از جایی که تلسکوپ فضایی هابل دیگر قدرت نشان دادن تصاویر را نداشت، بتواند تصویر بگیرد. هابل چشماندازهای خیرهکنندهای از جهان تولید کرد، اما نقاط کوری داشت: کهکشانها و ستارههای باستانی با نشانههای نوری که در محدوده مادون قرمز بودند، اساساً برای هابل قابل مشاهده نبودند. اصلاح آن نیازمند ابزاری با حساسیت تشخیص سیگنالهای فروسرخ بسیار ضعیفی بود که از میلیاردها سال نور دورتر از زمین منشأ میگیرند.
طرح نهایی تلسکوپ جیمز وب دارای ۱۸ آینه کاملا صاف از جنس بریلیم است که وقتی کاملا باز میشود، ۶٫۵ متر قطر دارد. این تلسکوپ به آشکارسازهای فروسرخ نزدیک و فروسرخ میانی پیشرفته مجهز است.
طراحی توصیفشده به تلسکوپ جیمز وب این امکان را میدهد که شکافهای هابل را پر کند. یکی از مواردی که تلکسوپ هابل قادر به ثبت آن نبود، نشانههای مربوط به کهکشان ۱۳٫۵ میلیارد سالهای است که برخی از اولین اتمهای اکسیژن و نئون را در کیهان تولید کرد. این تلسکوپ شگفتیهایی نیز حاصل کرده است. برای مثال، قادر به اندازهگیری ترکیب اتمسفر برخی انواع سیارههای فراخورشیدی بوده است.
پژوهشگران سراسر جهان منتظر مشاهدات تلسکوپ فضایی جیمز وب هستند. میکاکو ماتسورا، اخترفیزیکدان دانشگاه کاردیف بریتانیا درحال انجام دو مطالعه با JWST است. او به بررسی ایجاد و تخریب غبار کیهانی میپردازد که میتواند در شکلگیری ستارهها و سیارهها نقش داشته باشد. ماتسورا میگوید، درمقایسهبا تلسکوپهایی که گروه او در گذشته از آنها استفاده کرده است، «این درجهی کاملا متفاوتی از حساسیت و وضوح است.» بهگفتهی او: «شاهد رخدادن پدیدههای کاملا متفاوتی درون این اجرام هستیم و این شگفتآور است.»
میکروسکوپ الکترونی حجمی
میکروسکوپ الکترونی به دلیل وضوح فوقالعادهاش معروف است، اما عملکرد عالیاش بیشتر در «سطح» نمونهها است. دید عمیقتر مستلزم تهیه برشهای بسیار نازکی از نمونه است که اغلب برای اهدافی که زیستشناسان مدنظر دارند، کفایت نمیکند. لوسی کالیسون، متخصص میکروسکوپ الکترونی در موسسه فرانسیس کریک در لندن توضیح میدهد که برای پوشش دادن حجم فقط یک سلول، ممکن است به ۲۰۰ برش نیاز باشد. اکنون محققان وضوح میکروسکوپ الکترونی را به نمونههای بافت سهبعدی با ابعاد چند میلیمتر مکعب میآورند.
پیش از این، بازآفرینی چنین حجمهایی از تصاویر میکروسکوپ الکترونی دو بعدی (برای مثال برای ترسیم اتصالات عصبی مغز)، شامل فرایند پرزحمت آمادهسازی نمونه، تصویربرداری و محاسبات برای تلفیق تصاویر جداگانه و ایجاد یک تصویر کلی از نمونه بود. اکنون جدیدترین تکنیکهای میکروسکوپ الکترونی حجمی این فرایند را بسیار ساده میکند.
تصویربرداری متوالی که در آن از تیغهای با لبه الماس برای برش قطعات نازک متوالی از نمونهی جاسازیشده در رزین استفاده میشود و همزمان با هر برش تصویری از آن گرفته میشود، نسبتاً سریع است و میتواند با نمونههایی تا حد یک میلیمتر مکعب کار کند.
اگرچه، این روش وضوحِ عمقی ضعیفی ارائه میدهد، به این معنا که بازسازی حجمی حاصل نسبتاً مبهم خواهد بود. میکروسکوپ الکترونی روبشی مجهز به باریکه یونی متمرکز (FIB-SEM) لایههای نازکتری از نمونه تولید میکند و درنتیجه وضوح بهتری ارائه میدهد، اما برای نمونههای با حجم کمتر مناسبتر است.
کالیسون ظهور میکروسکوپ الکترونی حجمی را همچون «انقلاب خاموش» توصیف میکند که در آن پژوهشگران بیشتر نتایج تکنیک را برجسته میکنند تا تکنیکی که برای تولید آن استفاده کردهاند.
اکنون این وضعیت درحال تغییر است. بهعنوان مثال، در سال ۲۰۲۱، پژوهشگرانی که در ابتکار COSEM در ویرجینیا کار میکردند، دو مقاله در مجله نیچر منتشر کردند که حاکی از پیشرفت قابلتوجهی در بازنمایی داخل سلول بود.
ابتکار COSEM از میکروسکوپهای سفارشی و پیشرفته FIB-SEM استفاده میکند که حجمی را که میتوان در یک آزمایش از آن تصویربرداری کرد، حدود ۲۰۰ برابر افزایش میدهد و درعینحال وضوح فضایی خوبی ارائه میدهد. این تیم با استفاده از مجموعهای از این دستگاهها همراه با الگوریتمهای یادگیری عمیق توانست ساختارهای درون سلولی و ساختار چندین اندامک سلولی را در حجم کامل سهبعدی و طیف وسیعی از سلولها تعریف کند.
البته روشهای آمادهسازی نمونه و تسلط بر آن دشوار است و مجموعه دادههای حاصل بسیار زیاد هستند. اما این تلاش ارزشمند است: کالیسون بینشهایی را در پژوهشهای بیماریهای عفونی و زیستشناسی سرطان میبیند. او اکنون با همکارانش کار میکند تا امکانسنجی بازسازی کل مغز موش را با وضوح بالا بررسی کند. او متعقد است که این تلاش ممکن است بیش از یک دهه طول بکشد، میلیاردها دلار هزینه داشته باشد و نیم میلیارد گیگابایت داده تولید کند. او میگوید: «احتمالا به اندازه تلاشی که صرف تهیه اولین نقشه از ژنوم انسان شد، بزرگ خواهد بود.»
کریسپر در همه جا
ابزار ویرایش ژنوم CRISPR-Cas9 به درستی بهعنوان بهترین روش برای ایجاد تغییرات مشخص در مکانهای مورد هدف در سراسر ژنوم و محرک پیشرفت در حوزههای ژندرمانی، مدلسازی بیماری و سایر زمینههای پژوهشی شهرت پیدا کرده است. اما محدودیتهایی دررابطهبا محل استفاده از آن وجود دارد. اکنون پژوهشگران درحال پیدا کردن راههایی برای دور زدن این محدودیتها هستند.
ویرایش کریسپر توسط توالی RNA راهنمای کوتاهی سازماندهی میشود که آنزیم نوکلئاز Cas را به سمت توالی ژنومی هدف هدایت میکند. اما این آنزیم همچنین به توالی مجاوری به نام موتیف مجاور فاصلهانداز اولیه (PAM) نیاز دارد و بدون آن ویرایش احتمالا شکست خواهد خورد.
در بیمارستان عمومی ماساچوست در بوستون، بنجامین کلاینستیور از مهندسی پروتئین برای ایجاد نسخههای تقریبا فاقد PAM از آنزیم Cas9 استفاده کرده است. آنزیم Cas9 از باکتری استرپتوکوک پیوژنز گرفته میشود. یکی از نسخههای آنزیم Cas به PAM با سه باز نوکلئوتیدی متوالی نیاز دارد که یک نوکلئوتید A یا G در موقعیت وسط قرار داشته باشد. او میگوید: «این آنزیمها اکنون عملا کل ژنوم را میخوانند، درحالیکه آنزیمهای معمول کریسپر بین ۱ تا ۱۰ درصد ژنوم را میخوانند.» چنین الزاماتِ کمتر دقیقی در رابطه با PAM احتمال ویرایش خارج از هدف را افزایش میدهد، اما با مهندسی بیشتر میتوان اختصاصی بودن آنها را بهبود داد.
تیم کلاینستیور درحال مهندسی و آزمایش نسخههای مختلف آنزیم Cas9 هستند که هر کدام بهطور اختصاصی با دنبالههای متمایز PAM عمل میکنند. همچنین انواع طبیعی از Cas طبیعی وجود دارد که هنوز کشف نشده است. در طبیعت، سیستم CRISPR–Cas9 نوعی مکانیسم دفاعی باکتریایی دربرابر عفونت ویروسی است و میکروارگانیسمهای مختلف آنزیمهای متفاوتی با ترجیحات PAM متمایزی تکامل دادهاند.
آنا سرستو، ویروسشناس و نیکولا سگاتا پژوهشگر میکروبیوم در دانشگاه ترنتو ایتالیا بیش از یک میلیون ژنوم میکروبی را جستجو کردهاند تا انواع مختلفی از Cas9 را شناسایی کنند. طبق برآورد آنها، انواع مختلف Cas9 که شناسایی کردهاند، درمجموع میتوانند بیش از ۹۸ درصد از جهشهای شناختهشده مسبب بیماریها در انسانها را هدف قرار دهند. اگرچه فقط تعداد معدودی از آنزیمهای شناساییشده در سلولهای پستانداران عمل میکنند. سرستو میگوید: «ایده ما این است که تعداد زیادی از آنها را آزمایش کنیم تا ببینیم چه عواملی موجب میشوند آن آنزیمها به درستی کار کنند.»
کلاینستیور میگوید با توجه به بینشهای حاصل از این مخزن آنزیم طبیعی و تلاشهای مرتبط با مهندسی پروتئین، درنهایت به جعبه ابزار کاملی از ویرایشگرها دست پیدا میکنیم که به ما این امکان را میدهد که هر بازی را که میخواهیم، ویرایش کنیم.
تاریخگذاری رادیوکربن با دقت بالا
سال گذشته باستانشناسان از پیشرفت در تاریخگذاری رادیوکربن برای تعیین سال و حتی فصل دقیقی که در آن وایکینگها برای اولینبار وارد قاره آمریکا شدند، استفاده کردند.
تیمی به رهبری مایکل دی، کارشناس تحلیل ایزوتوپها در دانشگاه گرونینگن هلند و مارگوت کایتمز دانشجوی پسادکترای او با کار روی تکههای چوب بریدهشده که در سکونتگاهی در ساحل شمالی نیوفاوندلند کانادا کشف شده بود، مشخص کردند که آن درختان احتمالا در سال ۱۰۲۱ و احتمالا در فصل بهار قطع شده بودند.
دانشمندان از دهه ۱۹۴۰ از تاریخگذاری رادیوکربن ابزارهای باستانی ارگانیک استفاده میکنند تا زمان وقوع رویدادهای تاریخی را تخمین بزنند. آنها این کار را با اندازهگیری آثار ایزوتوپ کربن ۱۴ انجام میدهند. ایزوتوپ کربن ۱۴ درنتیجهی برهمکنش اشعههای کیهانی با جو زمین تشکیل میشود و طی هزاران سال به آرامی تجزیه میشود. اما دقت این تکنیک معمولا فقط در حد چند دهه است.

در سال ۲۰۱۲ همه چیز تغییر کرد. گروهی از پژوهشگران به سرپرستی فوسا میاکه از دانشگاه ناگویا در ژاپن نشان دادند که افزایش ناگهانی آشکاری در سطح کربن ۱۴ در حلقههای یک درخت سدر ژاپنی دیده میشود که مربوط به سالهای ۷۷۵-۷۷۴ پس از میلاد است. پژوهش بعدی نه تنها تأیید کرد که این افزایش ناگهانی در نمونههای چوب سراسر جهان که به این دوره تعلق دارند، وجود دارد، بلکه حداقل پنج جهش مشابه را شناسایی کرد که قدمت آنها به ۷۱۱۶ سال قبل از میلاد هم میرسید. پژوهشگران افزایش در سطح کربن ۱۴ را با فعالیت طوفان خورشیدی مرتبط دانستهاند، اما این فرضیه هنوز درحال بررسی است.
علت جهشها هرچه بود، این «رویدادهای میاکه» به پژوهشگران این امکان را داد تا با شناسایی یک رویداد خاص میاکه و سپس شمارش حلقههای درخت که پس از آن تشکیل شدند، بهطور دقیق سالی را که در آن این مصنوعات چوبی ساخته شده بود، تعیین کنند. کایتمز میگوید پژوهشگران حتی میتوانند بر اساس ضخامت بیرونیترین حلقه، فصلی را که در آن درخت قطع شد، نیز مشخص کنند.
باستانشناسان اکنون روش مذکور را برای سکونتگاههای عصر نوسنگی و مکانهای فوران آتشفشانی به کار میبرند و دی امیدوار است که بتواند از آن برای مطالعه امپراتوری مایا در آمریکای میانه استفاده کند. دی خوشبین است که در طی دهه آینده بتوانیم قدمت بسیاری از تمدنهای باستانی را تا سطح سالِ دقیق تعیین کنیم و روند توسعه تاریخی آنها را بهطور دقیق ازنظر زمانی مشخص کنیم. جستجوی میاکه برای شاخصهای تاریخی ادامه دارد. او میگوید: «به دنبال جهشهای دیگر کربن ۱۴ در طول ۱۰ هزار سال گذشته هستیم که شبیه رویداد ۷۷۵-۷۷۴ باشد.»
متابولومیکس سلول تک
متابولومیکس (مطالعه لیپیدها، کربوهیدراتها و سایر مولکولهای کوچکی که سلول را هدایت میکنند) در ابتدا مجموعه روشهایی برای شناسایی متابولیتها در جمعیتی از سلولها یا بافتها بود، اما اکنون به سطح سلولهای انفرادی رسیده است.
دانشمندان میتوانند از چنین دادههایی که در سطح سلولی به دست میآید، برای رفع پیچیدگیهای عملکردی در جمعیتهای وسیع سلولهای ظاهرا یکسان استفاده کنند. اما این انتقال با چالشهای دلهرهآوری همراه است.
متابولوم شامل تعداد زیادی مولکول با خواص شیمیایی متنوع است. تئودور الکساندروف، پژوهشگر متابولومیکس در آزمایشگاه زیستشناسی مولکولی اروپا در هایدلبرگ آلمان میگوید برخی از این مولکولها بسیار زودگذر با سرعت تغییر و تبدیل کمتر یک ثانیه هستند و تشخیص آنها میتواند دشوار باشد: درحالیکه توالییابی RNA سلول تک میتواند نزدیک به نیمی از مولکولهای RNA تولید شده در سلول یا ارگانیسم را شناسایی کند، بیشتر تجزیهوتحلیلهای متابولیک فقط بخش کوچکی از متابولیتهای یک سلول را پوشش میدهند. اطلاعات از دسترفته میتواند شامل بینشهای زیستی حیاتی باشد.
جاناتان سویدلر، شیمیدان دانشگاه ایلینوی در اربانا شمپین میگوید: «متابولوم بخش فعال سلول است. وقتی درحال مطالعه بیماری خاصی باشید، اگر میخواهید وضعیت سلول را بدانید، باید بتوانید متابولیتها را بررسی کنید.»
بسیاری از آزمایشگاههایی که درزمینهی متابولومیکس فعالیت میکنند، روی سلولهای جداشده کار میکنند. آنها سلولها را در مویرگها به دام میاندازند و با استفاده از طیفسنجی جرمی آنها را به صورت جداگانه تجزیهوتحلیل میکنند. درمقابل، روشهای تصویربرداری طیفسنجی جرمی اطلاعات فضایی را دراینباره ثبت میکنند که چگونه تولید متابولیتهای سلولی در مکانهای مختلف یک نمونه متفاوت است.
برای مثال، پژوهشگران میتوانند از روشی به نام MALDI (واجذب-یونش لیزری به کمک ماتریس) استفاده کنند که در آن پرتو لیرز از برشهای بافتی میگذرد و متابولیتها را برای تجزیهوتحلیل به کمک طیفسنجی جرمی آزاد میکند. این روش مختصات فضایی را که متابولیتها در نمونه از آن منشا میگیرند، نیز ثبت میکند.
در تئوری، هر دو روش میتوانند صدها ترکیب را در هزاران سلول را تعیین کنند، اما بهگفتهی سویدلر دستیابی به آن معمولا به سختافزارهای سفارشی و پیشرفته زیادی نیاز دارد که با هزینه بالایی همراه است.
اکنون، محققان درحال عمومیسازی این فناوری هستند. در سال ۲۰۲۱، گروه الکساندروف نرمافزار منبعباز SpaceM را معرفی کرد. این نرمافزار با استفاده از دادههای تصویربرداری میکروسکوپ نوری، استفاده از طیفسنج جرمی تجاری استاندارد را برای ایجاد پروفایل متابولمیکس فضایی سلولهای کشتشده ممکن میسازد.
تیم الکساندروف از SpaceM برای مشخص کردن صدها متابولیت از دهها هزار سلول انسان و موش استفاده کردند و از روشهای ترانسکریپتومیک تکسلولی استاندارد برای تقسیمبندی سلولها به گروههای مختلف استفاده کردند. الکساندروف میگوید او درمورد ایده تهیه اطلسهای متابولیک (مشابه اطلسهایی که برای ترانسکریپتومیکس ایجاد شده است) برای تسریع پیشرفت در این حوزه اشتیاق دارد.
مدلهای رویان آزمایشگاهی
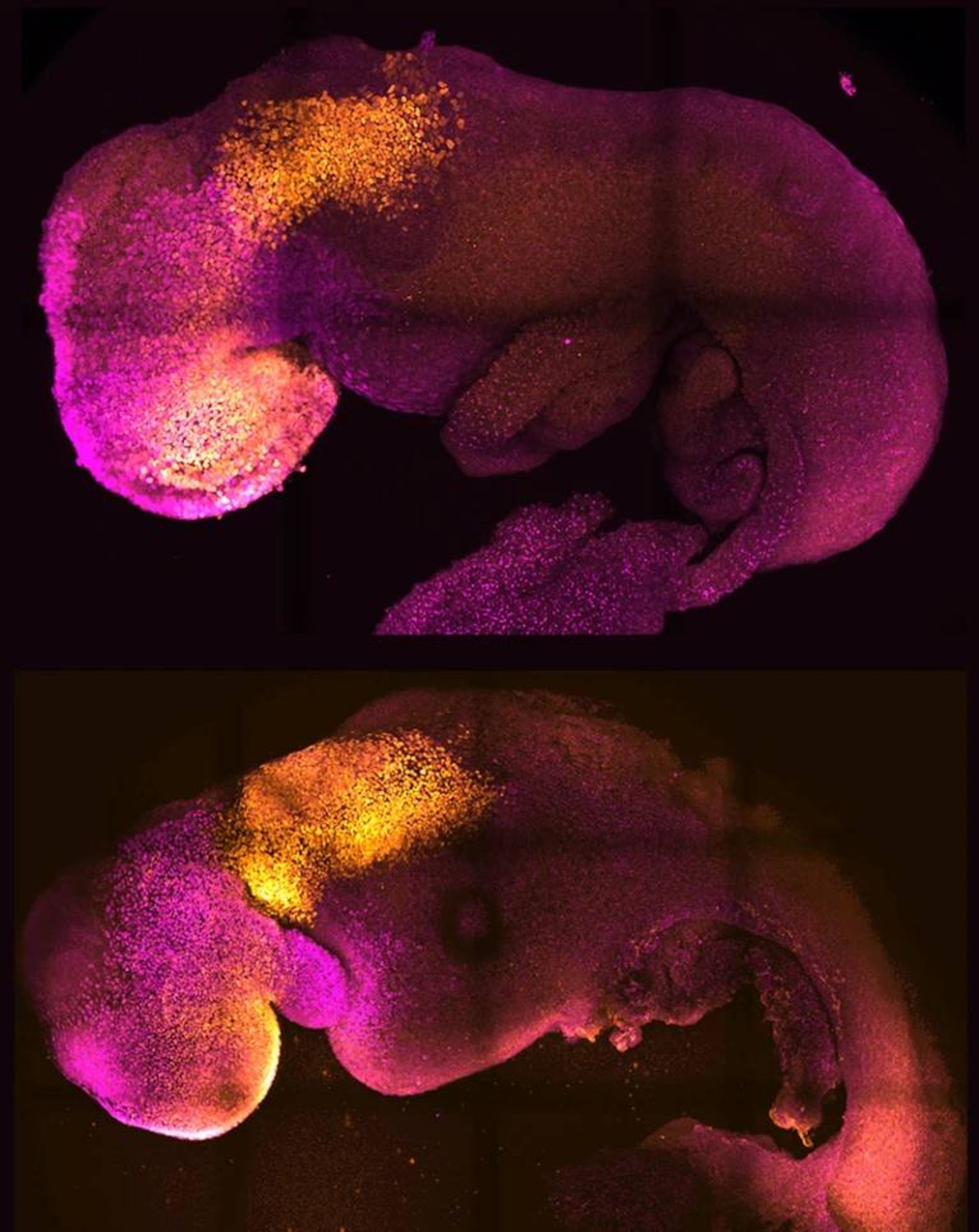
در سطح سلولی، سفر از تخمک بارورشده تا رویانی که کاملا شکل گرفته است، بهطور دقیقی برای انسان و موش تشریح شده است. اما ماشینآلات مولکولی هدایتکننده مراحل اولیه این فرایند هنوز بهخوبی شناسایی نشده است. اکنون افزایش مطالعات روی مدلهای امبریوئید (مدلهایی که از رویان تقلید میکنند) به پر کردن این شکافهای دانش کمک میکند و به پژوهشگر دید واضحتری از رویدادهای حیاتی اولیهای میدهد که میتوانند موفقیت یا شکست رشد رویان را تعیین کنند.
برخی از پیچیدهترین مدلها از آزمایشگاه ماگدالنا زرنیکا گوتز، زیستشناس موسسه فناوری کالیفرنیا در پاسادنا و دانشگاه کمبریج بریتانیا میآید. او و تیمش در سال ۲۰۲۲ نشان دادند که میتوانند بهطور کامل از سلولهای بنیادی رویانی، رویانهای موش مرحله لانهگزینی را تولید کنند.
همچون تمام سلولهای بنیادی پرتوان، سلولهای بنیادی رویانی میتوانند هر نوع سلول یا بافتی را تشکیل دهند، اما برای تکمیل رشد رویانی طبیعی باید با دو نوع سلول خارج رویانی در تعامل باشند.
تیم زرنیکا گوتز دریافت که چگونه میتوانند سلولهای بنیادی رویانی را وادار کنند تا سلولهای خارجرویانی را تشکل دهند. آنها نشان دادند که میتوان این سلولها را به همراه سلولهای بنیادی رویانی کشت داد تا مدلهای رویانی را تولید کرد که تا مراحلی رشد کنند که قبلا در محیط آزمایشگاه غیرممکن بود.
زرنیکا گوتز میگوید مدل امبریوئید آنها سر و قلب ایجاد میکند و میتپد. تیم او توانست از این مدل برای نشان دادن این موضوع استفاده کند که چگونه تغییر در ژنهای واحد میتواند رشد طبیعی رویان را از مسیر خارج کند.
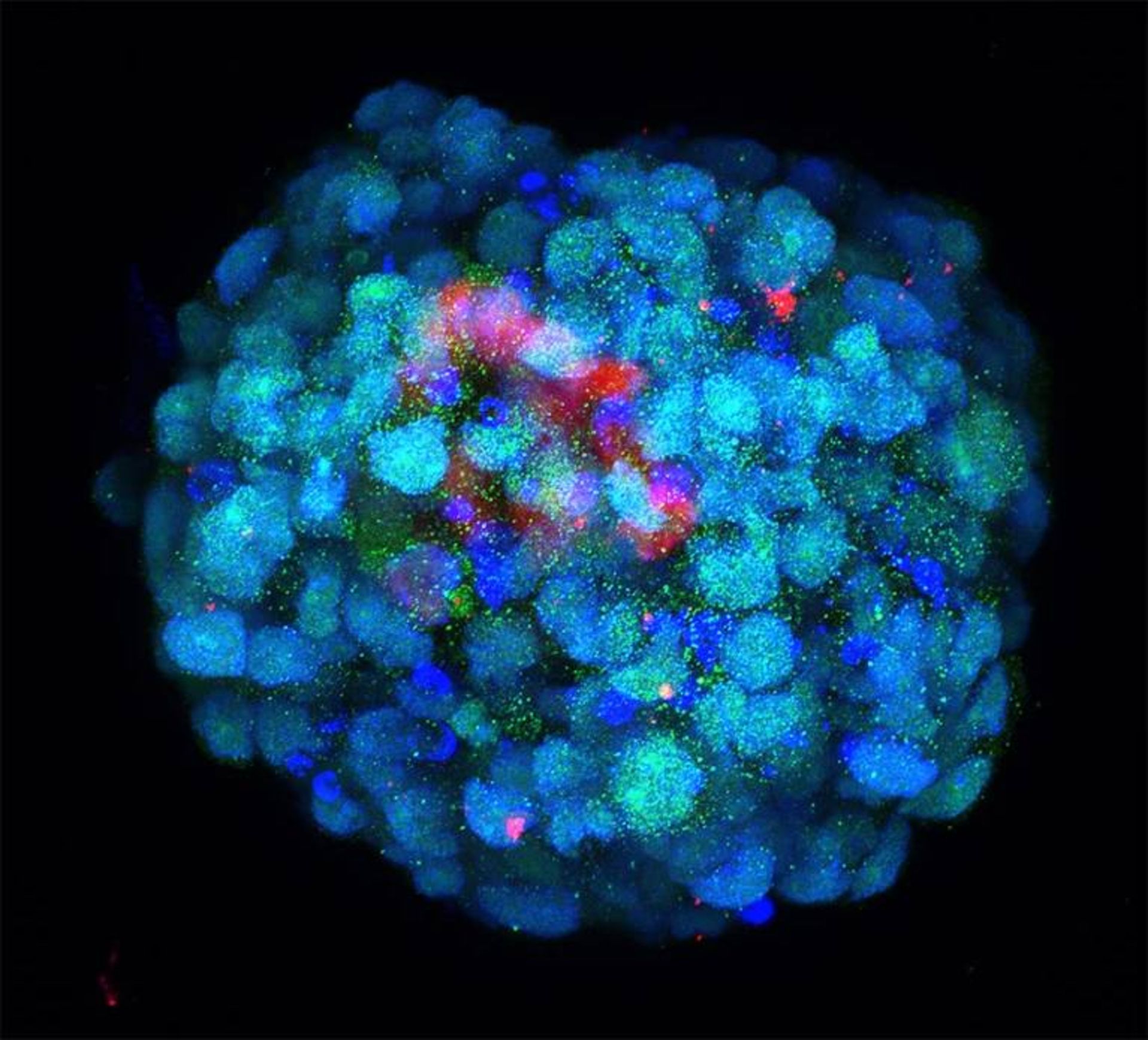
میگل استبان، زیستشناس سلولهای بنیادی و همکارانش در مؤسسه زیستپزشکی و سلامت گوانگژو در آکادمی علوم چین، روش دیگری را در پیش گرفتهاند: برنامهریزی مجدد سلولهای بنیادی انسان برای مدلسازی اولین مراحل رشد. استبان میگوید: «با این ایده شروع کردیم که حتی ممکن است امکان ساخت زیگوت (تخمک بارورشده) نیز وجود داشته باشد.» این تیم به طور کامل به هدف مذکور دست پیدا نکردند، اما نوعی استراتژی کشت را شناسایی کرد که سلولها را به سمت چیزی میبرد که شبیه رویان هشت سلولی انسان است.»
مرحله رویان هشت سلولی نقطه عطف مهمی در رشد است که با تغییر گسترده در بیان ژنها همراه است که درنهایت موجب ایجاد تبارهای سلولی رویانی و خارج رویانی میشود.
مدل استبان اگرچه ناقص است، اما ویژگیهای کلیدی سلولها را در رویان هشت سلولی طبیعی نشان میدهد و تفاوتهای مهمی را بین نحوه آغاز انتقال به مرحله هشت سلولی در انسان و موش آشکار کرده است. استبان میگوید: «دیدیم که یک فاکتور رونویسی که در موش حتی بیان هم نمیشود، در رویان انسان کل فرایند تبدیل را تنظیم میکند.»
درمجموع، این مدلها میتوانند به پژوهشگران کمک کنند تا متوجه شوند که چگونه چند سلول به پیچیدگی خیرهکننده بدن مهرهداران منجر میشوند.
انجام پژوهش روی رویان انسان در بسیاری از کشورها فراتر از روز چهاردهم رشد ممنوع است، اما پژوهشگران میتوانند در قالب همین محدودیتها نیز کارهای زیادی انجام دهند. استبان میگوید مدلهای نخستیسانهای غیرانسان جایگزین ممکنی را ارائه میکند و زرنیکا گوتز میگوید استراتژی رویان موش او میتواند همچنین رویانهای انسانی را تولید کند که تا روز ۱۲ رشد میکنند. او میگوید: «هنوز در همین مرحلهای که مطالعه آن راحت است و ممنوع نیست، سوالهای زیادی داریم که بپرسیم.»
نظرات