شرکتی که میخواهد آینده بیماریهای ژنتیکی را بازنویسی کند
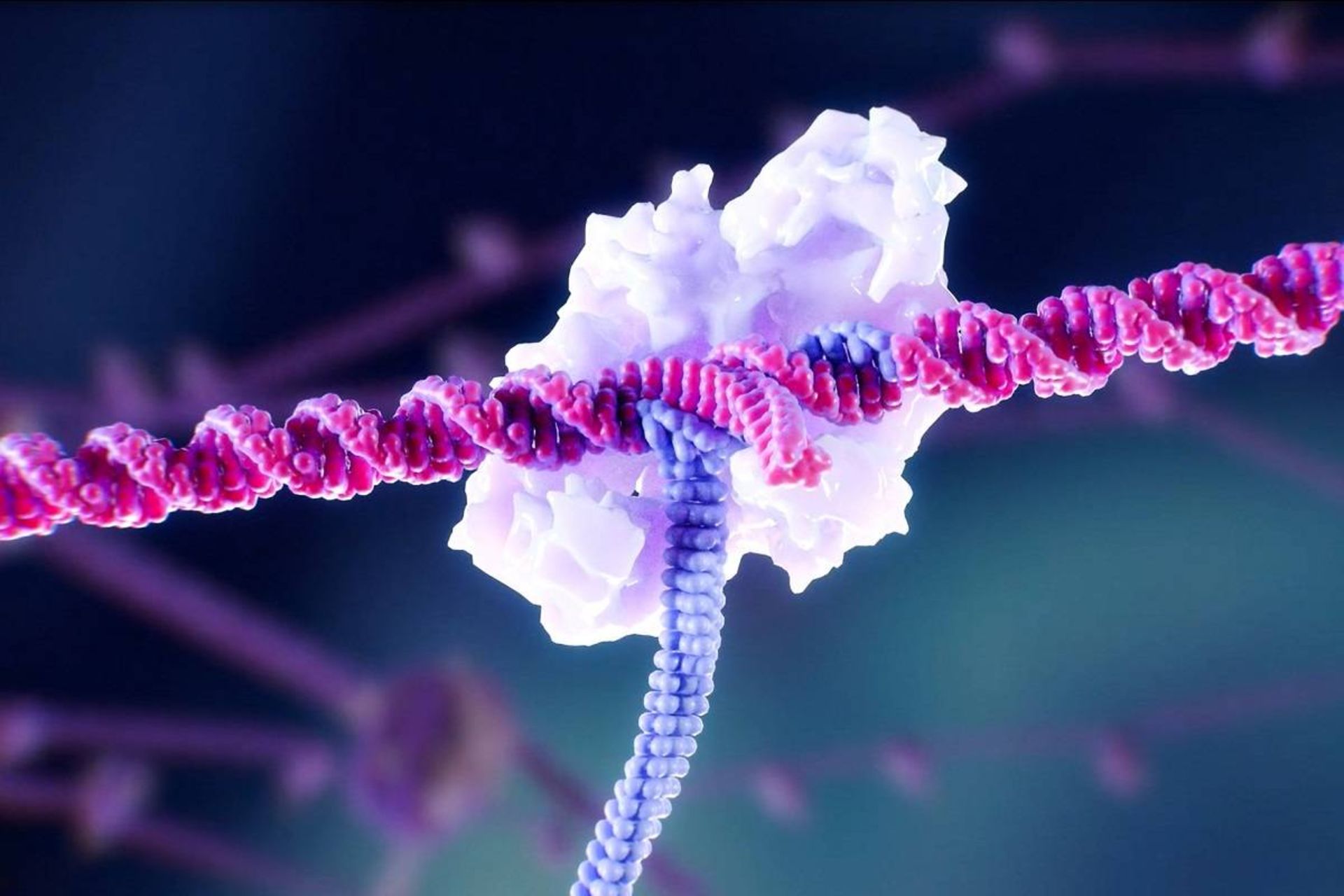
قابلیت کریسپر برای درمان بیماریهای توارثی سالها است که در عناوین خبری سایتهای مختلف بهچشم میخورد. دراینمیان، حداقل یک مورد نتایج امیدوارکنندهای حاصل کرده است. یک سال پس از اینکه ویکتوریا گری ۳۴ ساله تزریقی حاوی میلیاردها سلول کریسپریشده را دریافت کرد، هفتهی گذشته رادیو عمومی ملی آمریکا (NPR) اعلام کرد که آن سلولها هنوز زنده هستند و عوارض بیماری سلول داسی او را تخفیف میدهند. پژوهشگران میگویند هنوز خیلی زود است که آن را درمان بنامیم؛ اما بهعنوان اولین فرد دچار اختلال ژنتیکی که در آمریکا با موفقیت با کریسپر درمان میشود، این نقطهی عطف بزرگی است. با دَهها کارآزمایی بالینی دیگری که در حال انجام است، کریسپر تازه راه خود را آغاز کرده است. بااینحال، کریسپر بهدلیل دقتش در برش DNA، بهترین ابزار برای شکستن DNA است.
درمورد گری، ویرایشگر ژن ساخت شرکت کریسپر عمدا ژنی تنظیمی را در سلولهای مغز استخوان وی مختل کرد و تولید فرم خفته و جنینی از هموگلوبین را تقویت و بر جهشی غلبه کرد که به تولید ضعیف فرم بالغ این مولکول حملکنندهی اکسیژن منجر میشود. باتوجهبه محدودیتهای کریسپر، این روشی هوشمندانه است؛ اما برای بسیاری از وضعیتهای ارثی دیگر مؤثر نخواهد بود.
اگر بخواهید ژنی معیوب را با ژنی سالم جایگزین کنید، به ابزار متفاوتی نیاز دارید. همچنین، اگر لازم باشد مقدار زیادی DNA را وارد کنید، بخت چندانی ندارید. البته، جفری فونمالتزن، مدیرعامل استارتاپ جدیدی بهنام تسرا (Tessera Therapeutics)، میگوید دیگر اینطور نیست. این شرکت که در سال ۲۰۱۸ تأسیس شد، دو سال گذشته را صرف توسعهی گروه جدیدی از ابزارهای مولکولی کرده است که میتواند بسیاری از کارهایی را انجام دهد که کریسپر میتواند انجامشان دهد؛ البته تواناییهایی هم دارد که کریسپر از آن بیبهره است. ازجملهی این تواناییها، اتصال دقیق به قطعات طولانی از DNA است. فونمالتزن میگوید این ویرایش ژن نیست؛ بلکه «نوشتن ژن» است: «بهطور ساده، دربارهی آن بهعنوان نوع جدیدی فکر میکنیم. نوشتن ژن قابلیت حذفهای کامل یا تغییرات جفت بازی ساده را دارد؛ اما توانایی خاص آن در ایجاد تغییرات بزرگ در ژنوم است.»
برای درک نحوهی کارکرد نوشتن ژن، باید دربارهی نبردی باستانی و نامرئی بدانید که میلیونها سال در جریان بوده است. تقریبا از همان زمانیکه باکتریها وجود داشتهاند، ویروسهایی نیز بودهاند که بکوشند به آنها حمله کنند. این ویروسها که فاژ خوانده میشوند، مانند خط کدهای کامیپوتری مخربی هستند که سعی میکنند ژنوم باکتری را هک کنند تا آن را برای ساخت فاژهای بیشتر فریب دهند. هرروز، فاژها به مقادیر عظیمی از باکتریهای جهان (حداکثر ۴۰ درصد از جمعیت باکتریهای موجود در اقیانوسها) حمله میکنند. باکتریها برای اجتناب از این کشتار بیامان مجبور بودهاند دربرابر آنها بهطور مداوم سیستمهای دفاعی را تکامل دهند. کریسپر یکی از آنها است. این راهی است برای باکتری که بخشی از کد ژنتیکی فاژ (RNA یا DNA) را برباید و آن را مانند سیستم ایمنی اولیه در بانک حافظه ذخیره کند. جو پیترز، میکروبیولوژیست دانشگاه کرنل، میگوید این طولانیترین رقابت تسلیحاتی در تاریخ زمین بوده است: «آن سطح از فشار تکاملی موجب شده است نوآوریهای بیشماری در مکانیسمهای مولکولی برای دستکاری DNA و RNA بهوجود آید.»
باکتریها فقط مجبور نبودهاند با مهاجمان ویروسی خارجی مقابله کنند و ژنوم آنها از درون نیز با حملهی دائمی مواجه است. این عناصر ژنتیکی متحرک یا MGEها هستند که حاوی کدهای مستقل برای ساخت دستگاههایی بهمنظور برش و جایگذاری یا نسخهبرداری و جایگذاری خودشان در مکان جدید، درون ژنوم میزبان یا درون باکتریهای نزدیک خود هستند. اگر این MGEها خود را درون مناطق ژنی مهمی وارد کنند، باکتری از بین میرود. پیترز میگوید:
شما میتوانید دربارهی MGEها به همان شیوهای فکر کنید که دربارهی جهشها فکر میکنید. ما بدون آنها تکامل نخواهیم یافت؛ اما ۹۹/۹۹۹۹۹ درصد از آنها مضر هستند. باکتریها به هر قیمتی در تلاشند تا مانع از این شوند که MGEها ژنوم آنها را ناپایدار کنند.
باربارا مککلینتاک، گیاهشناس برندهی جایزهی نوبل، اولین گروه از MGEها را با نام ترانسپوزونها یا ژنهای پرشکننده در سال ۱۹۳۱ در ذرت کشف کرد. تکنیک او برای رنگآمیزی کروموزومهای گیاه به او این امکان را داد که وقتی قطعهای از توالی ژنتیکی کروموزومی به کروموزوم دیگر میپرد، او بتواند آن را ببیند. باوجوداین برای چندین دهه، دانشمندان هدف از این بخشهای تکراری DNA را نمیدانستند. برخی تا جایی پیش رفتند که بخشهای غنی از MGE را در ژنوم انسان DNA زائد لقب دادند. در این وضعیت ، دریافت بودجه برای مطالعهی آنها کار سختی بود؛ اما بهتدریج پژوهشگرانی نظیر پیترز دریافتند درواقع، MGEها در باکتریها سیستمهای بسیار تکاملیافتهای برای شناسایی DNA، نوشتن و جابهجایی آن هستند.
بهنظر میرسد خود کریسپر از ترانسپوزون خودسنتزشونده تکامل یافته باشد، همانطورکه یوجین کونین و کیرا ماکاروا، پژوهشگران NIH، در سال ۲۰۱۷ آن را تشریح کردند (کریسپر کدکنندهی پروتئینی است که قطعات خاص و تشخیصپذیر از DNA را برش میدهد که درون بانک حافظهی ژنتیکی آن ذخیره شده است). ترانسپوزونها به کریسپر این امکان را دادند که بتواند گردآوری آن بانک حافظه را آغاز کند.
در اوایل سال ۲۰۱۷، پیترز و کونین مقالهای منتشر کردند که شرح میداد چگونه این سیر تکاملی گاهی میتواند به موقعیت ابتدایی بازگردد. آنها نوعی ترانسپوزون را کشف کردند که برخی از ژنهای کریسپر را میربود تا بتواند میان باکتریهای میزبان جابهجا شود. آنها دریافتند این ابزارهای مولکولی برای برش و نسخهبرداری و چسباندن، بهطور مداوم میان MGEها و فاژها و باکتریها در حال جابهجایی است و بهصورت متناوب بهعنوان ابزارهایی برای دفاع یا حمله استفاده شپند. پیترز و کونین در پایان مقالهی خود نوشتند که این سیستمها بهطور بالقوه میتوانند با هدف کاربردهای مهندسی ژنوم مهار شوند.
بهگفتهی پیترز، مدتی نگذشت که شرکتهای مختلف با او تماس گرفتند که یکی از تماسها از طرف جیک روبنس، همبنیانگذار و مدیر ارشد نوآوری، شرکت تسرا بود. در سال ۲۰۱۹، شرکت همکاری پژوهشی را با آزمایشگاه کورنل درزمینهی کشف MGEهای جدید با قابلیت مهندسی ژنوم آغاز کرد (تسرا همکاریهای پژوهشی دیگری نیز دارد؛ اما مقامهای شرکت هنوز آنها را افشا نکردهاند).
عناصر ژنتیکی متحرک انواع مختلفی دارد که یکی از آنها، ترانسپوزونها هستند که میتوانند خود را از ژنوم جدا کنند و به منطقهی دیگری وارد شوند. رتروترانسپوزونها خود را نسخهبرداری و وارد محل جدید میکنند و با هربار تکثیر، اندازهی ژنوم را گسترش میدهند. هر دو با داشتن توالیهای خاصی در هر دو طرف کار میکنند که مرزهای آنها را مشخص میکند. در میان این توالیها، ژنهایی برای ساخت پروتئینها قرار دارند که آن مرزها را میشناسند و وقتی به ترانسپوزون میرسند، آن را قطع میکنند و شکاف باقی میگذارند. گفتنی است رتروترانسپوزونها آنها را ازطریق RNA واسط درون مکانهای جدید کپی میکنند. گروههای دیگری نیز وجود دارد؛ اما اینها دو موردی هستند که مدیران تسرا به کار روی آنها علاقمندند. این بداندلیل است که میتوانید رشتهی جدیدی از کد را بین آن توالیها اضافه کنید (مثلا نسخهی سالم و بدون جهش از ژن عامل بیماری) و به ماشینآلات MGE اجازه دهد تا انتقال این DNA درمانی را به کروموزومهای بیمار انجام دهند.
در دو سال گذشته، گروه بیوانفورماتیک شرکت پایگاههای دادهی عمومی را مطالعه کردهاند؛ پایگاههای که حاوی توالیهای ژنوم صدهاهزار گونهی باکتری است و دانشمندان آنها را از سراسر جهان جمعآوری کردهاند. در این دادههای ژنتیکی وسیع، آنها بهدنبال یافتن MGEهایی بودهاند که ممکن است برای ایجاد این نوع تغیرات درمانی DNA مناسب باشند. تاکنون، این دانشمندان حدود ششهزار رتروترانسپوزون که شرکت آنها را RNA writers مینامد و دوهزار ترانسپوزون (DNA writers) را شناسایی کردهاند که ظرفیتهایی در این زمینه نشان میدهند.
گروه ۳۵ نفرهای از دانشمندان تسرا مشغول انجام آزمایشهایی در سلولهای انسانی بودهاند تا نحوهی عمل دقیق هریک از این MGEها را دریابند. گاهی اوقات، نویسندهی ژن (Gene Writer) طبیعی امیدوارکننده در آزمایشگاه تسرا دستکاری میشود تا دقیقتر عمل کند یا به مکان دیگری برود. این شرکت هنوز ثابت نکرده است که هریک از این نویسندگان ژن بتوانند یک بیماری توارثی را حذف کنند؛ اما در مدلهای موش، توانسته است از آنها برای واردکردن نسخههای زیادی از ژن پروتئین فلورسنت سبز بزرگ در ژنوم حیوانات استفاده کند که راهی برای اثبات این موضوع است و آنها بااطمینان میتوانند DNA طراح را در مکان خود قرار دهند.
دانشمندان دَهها سال است که درخشش مصنوعی را در حیوانات ایجاد میکنند؛ ولی تفاوت رویکرد تسرا آن است که دانشمندان شرکت مذکور برای رخداد این اتفاق فقط باید قطعهای از RNA را تزریق کنند. این بستهی کوچک RNA تمام اطلاعات لازم برای بهکارگیری آنزیمهای موردنیاز برای ساخت مولکول جدید DNA را که کدکنندهی پروتئین فلورسنت سبز است، بههمراه دارد و سپس آن را به کروموزوم موش وارد میکند.
این موضوع مهمی است؛ زیرا دو مورد از بزرگترین موانع موجود در پزشکی ژنتیک مدتها است که چگونگی تحویل ابزار تغییردهندهی DNA به سلولهای درست و تغییر مقدار کافی از آنها بهگونهای است که مؤثر باشد. ژندرمانی سنتی متکیبر انتقال ژن سالم بهوسیلهی ویروسهای خالی است و نمیتواند قطعات بزرگ DNA را حمل کند. این درمانها تنها یکبار انجامدادنی است؛ زیرا بدن انسان دربرابر پوستهی ویروس واکنش ایمنی نشان میدهد.
دانشمندانی که از کریسپر استفاده میکنند، با همین مسائل مواجه بودهاند؛ بههمیندلیل، اولین موفقیتها درزمینهی اختلالاتی مانند بیماری سلول داسی و سرطان حاصل شده است که در آن، میتوانید سلولها را خارج از بدن ویرایش و سپس آنها را دوباره به بدن تزریق کنید. دانشمندان در خارج از بدن میتوانند بهجای تکیه بر وکتور ویروسی، اجزای سازندهی کریسپر را مستقیما به سلولها تزریق کنند؛ اما دستیابی به توانایی الحاق DNA جدید به ژنوم موجود زنده فقط با یکبار تزریق RNA قبلا هرگز انجام نشده است.
امکان تزریق فقط یک قطعه از RNA که مشابه رویکرد شرکت واکسنسازی مدرنا است، میتواند این کار را برای پژوهشگران آسانتر کند که سراغ وضعیتهای ژنتیکی بروند که در آنها، درمان افزودن قطعات بزرگی از کد ژنتیکی ترمیمی را شامل میشود. فیودور اورﻧﻮف، متخصص ویرایش ژن دانشگاه کالیفرنیا در برکلی میگوید: «این رویکرد واقعا جالبی است و کاملا ارزش دنبالکردن را دارد.» بااینحال، او معتقد است هنوز خیلی زود است که بگوییم نوشتن ژن از کریسپر یا نسخهی نسل آیندهی آن، یعنی ویرایش اولیه یا هر فناوری ویرایش ژن درحالتوسعهای بهتر است. او بیان میکند: «آنچه از سه دهه کار در این زمینه آموختهام، این است که تنها کلینیک است میتواند به شما بگوید درنهایت کدام فناوری بهترین گزینه برای درمان بیماری خاصی است.»
تسرا هنوز با هرگونه کارآزمایی انسانی اینچنینی حداقل یک سال فاصله دارد. این شرکت بهتازگی کار توسعهی گروه تولید اولیه را آغاز کرده است. مقامهای این شرکت تاکنون دربارهی این موضوع صحبتی نکردهاند که قصد دارند ابتدا روی کدام بیماریها کار کنند و فقط گفتهاند احتمالا روی بیماریهای ژنتیکی نادر کار خواهند کرد. فونمالتزن میگوید آنها قصد دارند تاحدممکن انواع موجود و مهندسیشده از این عوامل را بررسی کنند؛ اما هدف آنها رسیدن به مجموعه ماشینآلات مولکولی است که بتواند قبل از رفتن به کلینیک، به بسیاری از بیماریهای انسانی بپردازد. فونمالتزن میگوید: «تقریبا اطمینان داریم که در دهههای آینده، پزشکی ژنتیک یکی از دستههای جدید خارقالعادهی پزشکی خواهد بود.» این زمینه از علم قطعا در حال شتابگرفتن است. گفتنی است چند دهه طول کشید تا ژندرمانی به نخستین کارآزماییهای انسانی برسد و این مدت برای کریسپر هفت سال بود. برای نوشتن ژن، ممکن است مجبور نباشیم آنقدر منتظر بمانیم.
نظرات